质粒是基因工程的核心载体,高效携带外源基因,是基因与细胞治疗、mRNA疫苗/药物、DNA疫苗、重组蛋白、基因编辑等下游应用的基础。据Grand View Research测算,2024年全球AAV基因治疗药物市场规模约10.2亿美元,预计到2030年将达到27.78亿美元,2025到2030年的CAGR高达18.5%。截至2025年4月10日,国内第一款AAV基因疗法药物获批上市,另外还有40余款AAV基因药物IND临床获批。随着下游细分领域如AAV基因治疗药物、mRNA肿瘤疫苗等的快速发展,对质粒产能、通量、质量、交付效率等提出了更高的要求。
行业需求“爆发”,传统质粒生产能否持续满足需求?
传统质粒DNA生产主要依靠大肠杆菌发酵,面对各技术路线开发周期要求不断提高,该方式已逐渐暴露弊端:
生产周期长:GMP级质粒交付周期通常超过2个月;
工艺复杂:针对不同需求(LVV、AAV、mRNA等)的质粒生产,细胞库构建和发酵纯化工艺验证周期长;
杂质影响的不确定性:抗性基因、宿主蛋白/DNA残留、细菌内毒素残留等存在安全性风险;
稳定性差:在传代培养过程中,发生基因重组概率高;
通量低:依靠发酵培养和层析纯化技术,无法实现通量生产,难以满足早研筛选需求。
无细胞(Cell-free)DNA制备或带来下一个合成时代
Cell-free DNA制备技术是指在体外利用复制酶将质粒模板进行大量扩增,从而获得足量的DNA。该技术无需进行多级细胞建库和菌液发酵,生产周期短,反应可控,在生产周期要求高,且需求量较少的应用场景中优势凸显,例如个性化药物、毒性基因合成、无细胞蛋白合成等。
Cell-free DNA制备技术优势明显
生产周期短:2~3天内即可简单快速扩大质粒规模
工艺简单:酶促合成体系简单,易于进行高通量合成
精度高:高保真扩增酶有效避免突变,无细胞内抗性基因干扰及代数扩增突变
Cell-free DNA制备流程
Cell-free DNA制备可分为两个工艺路线:
基于Phi29 DNA聚合酶的滚环复制(RCA)路线:

基于TelN Protelomerase的doggybone DNA(dbDNA)制备路线:

当mRNA遇上Cell-free DNA
mRNA疫苗在个性化肿瘤疗法领域中的优势明显,各大RNA相关企业纷纷布局肿瘤疫苗管线。个性化癌症疫苗因其量身设计和制造的特性,使其制备的过程中对GMP线性化质粒需求量相对较少,同时需要快速生产。Cell-free DNA合成技术仅在2~3天内就可以快速扩大生产规模,且设备小型,操作简易灵活,成为非常适合个性化mRNA用质粒的生产方式。当使用Cell-free DNA进行mRNA模板制备,mRNA质量是否满足标准要求呢?
近岸蛋白提供快速扩增Super Phi29 DNA聚合酶(目录号:E012)、TelN Protelomerase(目录号:M101)及全套mRNA合成用酶,经验证,使用上述两种Cell-free DNA合成工艺制备的mRNA模板,体外转录得到的mRNA产量、完整性及加帽率等各方面均符合要求。
数据展示
Super Phi29 DNA聚合酶
扩增速度快,3h可完成扩增反应
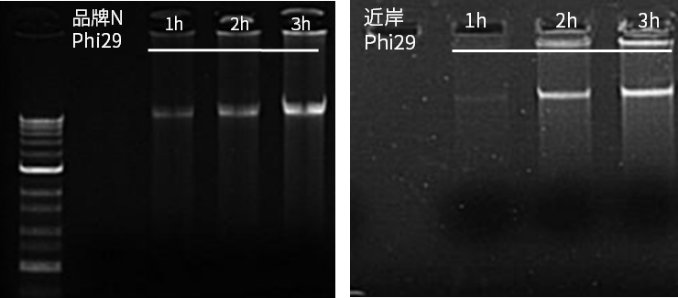
图例)同时对1ng模板进行扩增,近岸蛋白Super Phi29和N品牌产品在1h时均出现扩增条带,3h完成扩增反应。
酶活高、灵敏度高
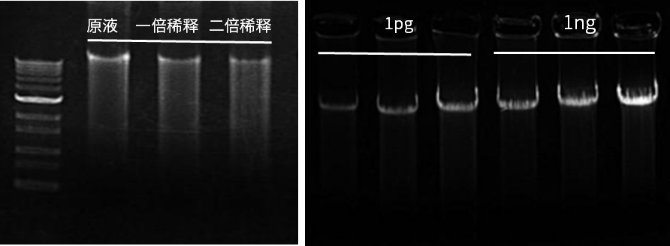
图例)近岸蛋白Super Phi29具有较高的酶活性,较高倍数的稀释仍然能够扩增1ng模板,同时,可以对pg级模板进行扩增。
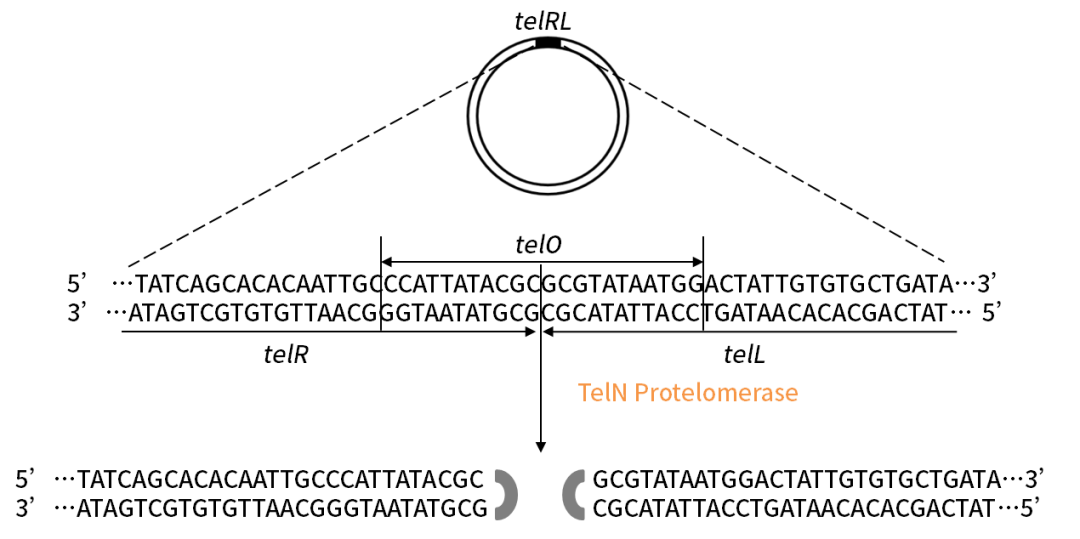
TelN Protelomerase
TelN Protelomerase可以特异性的识别dsDNA上的telRL序列(56bp)切割dsDNA,并在切割位点形成共价封闭末端,有效地将环状DNA转化为有封闭末端的线性DNA。
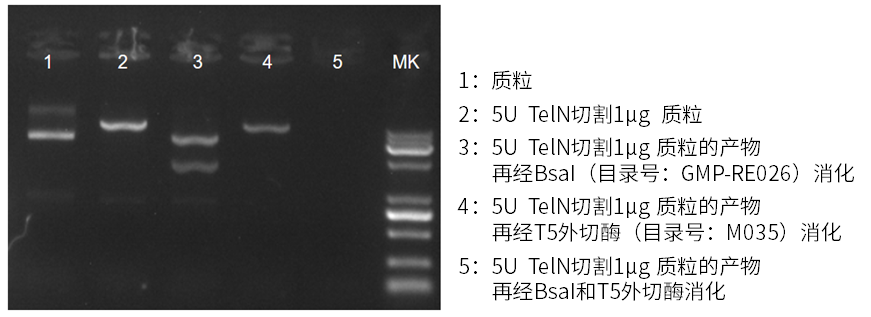
性能验证
利用TelN酶及T5外切酶特性,在质粒中同时设计TelN酶和BsaI酶识别位点:经TelN酶切后成封闭末端的线性双链DNA,不能被T5外切酶消化;再经BsaI切割后,产生新的非封闭末端,从而可以被T5外切酶消化。
使用Cell-free DNA进行体外转录
RCA+IVT获得符合要求的mRNA
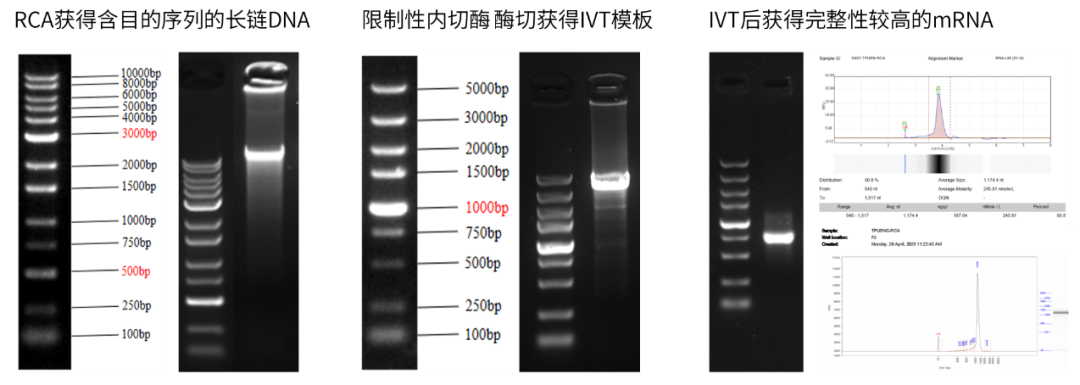

图例)通过RCA获得长链DNA,10ng质粒投入获得约30μg体外转录模板,有效进行模板放大。经限制性内切酶酶切获得IVT模板,体外转录后得到的mRNA产量高,完整性好,且GGG起始模板与Cap1 GAG帽结构进行共转录,加帽率大于95%,总蛋白残留未检出。
dbDNA+IVT获得符合要求的mRNA
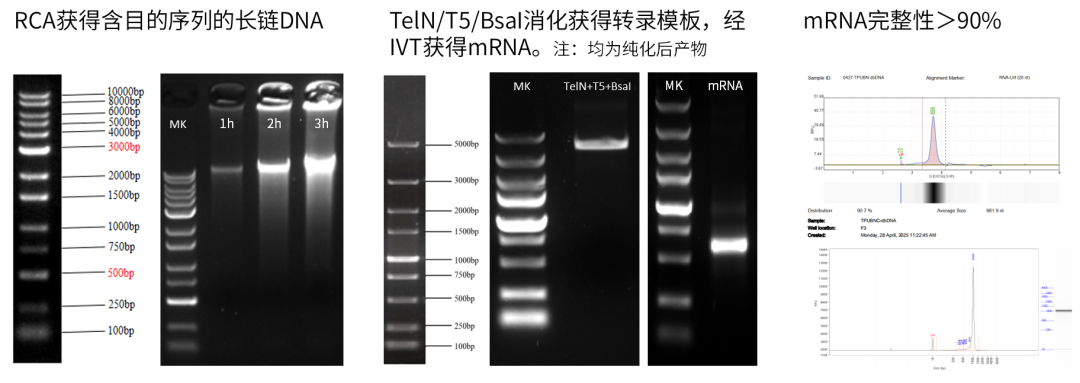

图例)通过RCA获得长链DNA,10ng质粒投入获得约10-30μg dbDNA,有效进行模板放大。经TelN酶/T5外切酶/限制性内切酶酶切获得IVT模板,体外转录后得到的mRNA产量高,完整性好,且GGG起始模板与Cap1 GAG帽结构进行共转录,加帽率大于95%,总蛋白残留未检出。
值得注意的是,dbDNA技术源自英国Touchlight公司开发的专利体系,采用该路径进行DNA生产可能涉及一定的专利费用,但这并不妨碍其技术在实际应用中的巨大潜力。尤其在以质粒为基础的生物疗法领域,如 AAV、LVV载体以及 DNA 疫苗中,dbDNA有望展现出突出的优势。同时,以RCA技术为核心的Cell-free DNA制备,与mRNA药物生产流程相结合,将为个性化肿瘤治疗提供更高效、灵活的候选分子筛选方案,加速药物开发进程。
科研级相关产品推荐
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
